Ядро атома
Содержание
Понятие атом. Строение атома и атомного ядра

Как уже отмечалось,атом состоит из трех видов элементарныхчастиц: протонов, нейтронов и электронов.Атомное ядро – центральная часть атома,состоящая из протонов и нейтронов.Протоны и нейтроны имеют общее названиенуклон, в ядре они могут превращатьсядруг в друга. Ядро простейшего атома –атома водорода – состоит из однойэлементарной частицы – протона.

Диаметрядра атома равен примерно 10-13– 10-12см и составляет 0,0001 диаметра атома.Однако, практически вся масса атома (99,95 – 99,98 %) сосредоточена в ядре.
Еслибы удалось получить 1 см3чистого ядерного вещества, масса егосоставила бы 100 – 200 млн. т. Масса ядраатома в несколько тысяч раз превосходитмассу всех входящих в состав атомаэлектронов.
Протон– элементарная частица, ядро атомаводорода. Масса протона равна 1,6721х10-27кг, она в 1836 раз больше массы электрона.Электрический заряд положителен и равен1,66х10-19Кл. Кулон – единица электрическогозаряда, равная количеству электричества,проходящему через поперечное сечениепроводника за время 1с при неизменнойсиле тока 1А (ампер).

Каждый атом любогоэлемента содержит в ядре определенноечисло протонов. Это число постоянноедля данного элемента и определяет егофизические и химические свойства.
Тоесть, от количества протонов зависит,с каким химическим элементом мы имеемдело. Например, если в ядре один протон– это водород, если 26 протонов – этожелезо. Число протонов в атомном ядреопределяет заряд ядра (зарядовое числоZ) и порядковый номер элемента впериодической системе элементов Д.И.Менделеева (атомный номер элемента).
Нейтрон– электрическинейтральная частица с массой 1,6749х10-27кг,в 1839 раз больше массы электрона. Нейронв свободном состоянии – нестабильнаячастица, он самостоятельно превращаетсяв протон с испусканием электрона иантинейтрино. Период полураспаданейтронов (время, в течение которогораспадается половина первоначальногоколичества нейтронов) равен примерно12 мин.
Однако в связанном состояниивнутри стабильных атомных ядер онстабилен. Общее число нуклонов (протонови нейтронов) в ядре называют массовымчислом (атомной массой – А). Числонейтронов, входящих в состав ядра, равноразности между массовым и зарядовымчислами: N = A – Z.
Электрон– элементарнаячастица, носитель наименьшей массы –0,91095х10-27ги наименьшего электрического заряда –1,6021х10-19 Кл.Это отрицательно заряженная частица.Число электронов в атоме равно числупротонов в ядре, т.е. атом электрическинейтрален.
Позитрон– элементарная частица с положительнымэлектрическим зарядом, античастица поотношению к электрону. Масса электронаи позитрона равны, а электрическиезаряды равны по абсолютной величине,но противоположны по знаку.

Различныетипы ядер называют нуклидами. Нуклид –вид атомов с данными числами протонови нейтронов.
В природе существуют атомыодного и того же элемента с разнойатомной массой (массовым числом): 1735Cl, 1737Clи т. д. Ядра этих атомов содержат одинаковоечисло протонов, но различное числонейтронов.
Разновидности атомов одногои того же элемента, имеющие одинаковыйзаряд ядер, но различное массовое число,называются изотопами.Обладая одинаковым количеством протонов,но различаясь числом нейтронов, изотопыимеют одинаковое строение электронныхоболочек, т. е. очень близкие химическиесвойства и занимают одно и то же местов периодической системе химическихэлементов.

Изотопыобозначают символом соответствующегохимического элемента с расположеннымсверху слева индексом А – массовымчислом, иногда слева внизу приводитсятакже число протонов (Z). Например,радиоактивные изотопы фосфора обозначают32Р,33Рили 1532Ри 1533Рсоответственно. При обозначении изотопабез указания символа элемента массовоечисло приводится после обозначенияэлемента, например, фосфор – 32, фосфор– 33.
Большинствохимических элементов имеет по несколькоизотопов. Кроме изотопа водорода1Н-протия,известен тяжелый водород 2Н-дейтерийи сверхтяжелый водород 3Н-тритий.У урана 11 изотопов, в природных соединенияхих три (уран 238, уран 235, уран 233). У них по92 протона и соответственно 146,143 и 141нейтрон.
В настоящее времяизвестно более 1900 изотопов 108 химическихэлементов. Из них к естественным относятсявсе стабильные (их примерно 280) иестественные изотопы, входящие в составрадиоактивных семейств (их 46). Остальныеотносятся к искусственным, они полученыискусственным путем в результатеразличных ядерных реакций.

Термин»изотопы» следует применять только втех случаях, когда речь идет об атомаходного и того же элемента, например,изотопы углерода12С и 14С.Если подразумеваются атомы разныххимических элементов, рекомендуетсяиспользовать термин «нуклиды», например,радионуклиды 90Sr,131J, 137Cs.
Атом – это мельчайшая частица химического вещества, которая способна сохранять его свойства. Слово «атом» происходит от древнегреческого «atomos», что означает «неделимый». В зависимости о того, сколько и каких частиц находится в атоме, можно определить химический элемент.
Пропорции внутри атома
Если представить себе атом, размеры которого будут сопоставимы с размерами международного спортивного стадиона, тогда можно визуально получить следующие пропорции.
Электроны атома на таком «стадионе» будут располагаться на самом верху трибун. Каждый из них будет иметь размеры меньше, чем булавочная головка. Тогда ядро будет расположено в центре этого поля, а его размер будет не больше, чем размер горошины.

Иногда люди задают вопрос, как в действительности выглядит атом. На самом деле он в буквальном смысле слова не выглядит никак – не по той причине, что в науке используются недостаточно хорошие микроскопы. Размеры атома находятся в тех областях, где понятие «видимости» просто не существует.
Атомы обладают очень малыми размерами. Но насколько малы в действительности эти размеры? Факт состоит в том, что самая маленькая, едва различимая человеческим глазом крупица соли содержит в себе порядка одного квинтиллиона атомов.
Если же представить себе атом такого размера, который мог бы уместиться в человеческую руку, то тогда рядом с ним находились бы вирусы 300-метровой длины. Бактерии имели бы длину 3 км, а толщина человеческого волоса стала бы равна 150 км.

В лежачем положении он смог бы выходить за границы земной атмосферы. А если бы такие пропорции были действительны, то человеческий волос в длину смог бы достигать Луны. Вот такой он непростой и интересный атом, изучением которого ученые продолжают заниматься и по сей день.
Атом является наименьшей частицей элемента, сохраняющей его характеристики.Строение атомного ядра.Атомы различных элементов отличаются друг от друга. Поскольку существует свыше 100 различных элементов, то существует и свыше 100 различных видов атомов.Рис 1-2. Части атома.Каждый атом имеет ядро, расположенное в центре атома.
Оно содержит положительно заряженные частицы – протоны и незаряженные частицы – нейтроны.Электроны, отрицательно заряженные частицы, вращаются вокруг ядер (см. Рис. 1-2).Количество протонов в ядре атома называется атомным номером элемента.Рис.

1-3. Электроны, расположенные на оболочках вокруг ядра.Атомные номера позволяют отличить один элемент от другого. Каждый элемент имеет атомный вес.
Атомный вес — это масса атома, которая определяется общим числом протонов и нейтронов в ядре. Электроны практически не дают вклада в общую массу атома, масса электрона составляет только 1/1845 часть массы протона и ею можно пренебречь.Электроны вращаются по концентрическим орбитам вокруг ядра. Каждая орбита называется оболочкой.
Эти оболочки заполняются в следующей последовательности: сначала заполняется оболочка К, затем L, М, N и т. д. (см.

Рис. 1-3). Максимальное количество электронов, которое может разместиться на каждой оболочке, показано на Рис.
1-4.Внешняя оболочка называется валентной, и количество электронов, содержащееся в ней, называется валентностью. Чем дальше от ядра валентная оболочка, тем меньшее притяжение со стороны ядра испытывает каждый валентный электрон. Таким образом, потенциальная возможность атома присоединять или терять электроны увеличивается, если валентная оболочка не заполнена и расположена достаточно далеко от ядра.Рис.
1-4 и 1-5. Состав атома.Электроны валентной оболочки могут получать энергию. Если эти электроны получат достаточно энергии от внешних сил, они могут покинуть атом и стать свободными электронами, произвольно перемещающимися от атома к атому.

Материалы, содержащие большое количество свободных электронов, называются проводниками.Рис. 1-6. Валентность меди.На Рис.
1-5 сравниваются проводимости различных металлов, используемых в качестве проводников. В таблице серебро, медь и золото имеют валентность, равную единице (см. Рис.
1-6). Однако серебро является лучшим проводником, поскольку его валентные электроны слабее связаны.Изоляторы, в противоположность проводникам, препятствуют протеканию электричества. Изоляторы стабильны благодаря тому, что валентные электроны одних атомов присоединяются к другим атомам, заполняя их валентные оболочки, препятствуя, таким образом, образованию свободных электронов.Рис.

1-7. Диэлектрические свойства различных материалов, используемых в качестве изоляторов.Материалы, классифицируемые как изоляторы, сравниваются на Рис. 1-7.
Слюда является наилучшим изолятором, потому что она имеет наименьшее число свободных электронов на своих валентных оболочках.Промежуточное положение между проводниками и изоляторами занимают полупроводники.Полупроводники не являются ни хорошими проводниками, ни хорошими изоляторами, но они важны, потому что их проводимость можно изменять от проводника до изолятора. Кремний и германий являются полупроводниковыми материалами.Об атоме, который имеет одинаковое число электронов и протонов, говорят, что он электрически нейтрален. Атом, получающий один или более электронов, не является электрически нейтральным.
Он становится отрицательно заряженным и называется отрицательным ионом. Если атом теряет один или более электронов, то он становится положительно заряженным и называется положительным ионом. Процесс присоединения или потери электронов называется ионизацией.Ионизация играет большую роль в протекании электрического тока.Поделитесь полезной статьей:

Первая страница статьи Э. Резерфорда в журнале Philosophical Magazine, 6, 21 (1911), в которой впервые водится понятие «атомное ядро».
Открытое 100 лет назад Э.Резерфордом атомное ядро является связанной системой взаимодействующих протонов и нейтронов.
Каждое атомное ядро по-своему уникально.Для описания атомных ядер разработаны различные модели, описывающие отдельные специфические особенности атомных ядер. Изучение свойств атомных ядер открыло новый мир – субатомный квантовый мир, привело к установлению новых законов сохранения и симметрии. Полученные в ядерной физике знания широко используются в естествознании от изучения живых систем до астрофизики.
1. 1911 г. Резерфорд открывает атомное ядро.
В июньском 1911 г. номере журнала «Philosophical Magazine» была опубликована работа Э. Резерфорда «Рассеяние α- и β-частиц веществом и строение атома», в которой впервые было введено понятие «атомное ядро».
Э.Резерфорд проанализировал результаты работы Г. Гейгера и Э.Марсдена по рассеянию α-частиц на тонкой золотой фольге, в которой совершенно неожиданно было обнаружено, что небольшое число α-частиц отклоняется на угол больше 90°. Этот результат противоречил господствовавшей в то время модели атома Дж.
Дж. Томсона, согласно которой атом состоял из отрицательно заряженных электронов и равного количества положительного электричества равномерно распределенного внутри сферы радиуса R ≈ 10-8 см. Для объяснения результатов, полученных Гейгером и Марсденом, Резерфорд разработал модель рассеяния точечного электрического заряда другим точечным зарядом на основе закона Кулона и законов движения Ньютона и получил зависимость вероятности рассеяния α-частиц на угол θ от энергии E налетающей α-частицы

Измеренное Гейгером и Марсденом угловое распределение α-частиц можно было объяснить только в том случае, если предположить, что атом имеет центральный заряд, распределенный в области размером <10-12 см.
Результирующий заряд ядра приблизительно равен Ae/2, где A – вес атома в атомных единицах массы, e – фундаментальная единица заряда. Точность определения величины заряда ядра золота составила ≈ 20%.Так возникла планетарная модель атома, согласно которой атом состоит из массивного положительно заряженного атомного ядра и вращающихся вокруг него электронов. Так как в целом атом электрически нейтрален – положительный заряд ядра компенсировался отрицательным зарядом электронов.
Число электронов в атоме определялось величиной заряда ядра Z.1909–1911 г.Опыты Г. Гейгера и Э. МарсденаВ 1910 г.

к Резерфорду в лабораторию приехал работать молодой ученый по имени Марсден. Он попросил Резерфорда дать ему какую-нибудь очень простую задачу.Резерфорд поручил ему считать α-частицы, проходящие через материю, и найти их рассеяние. При этом Резерфорд заметил, что по его мнению Марсден ничего заметного не обнаружит.
Свои соображения Резерфорд основывал на принятой в то время модели атома Томсона.В соответствии с этой моделью атом представлялся сферой размером 10–8см с равнораспределенным положительным зарядом, в которую были вкраплены электроны. Гармонические колебания последних определяли спектры лучеиспускания. Легко показать, что α-частицы должны были легко проходить через такую сферу, и особенного рассеяния их нельзя было ожидать.Всю энергию на пути своего пробега α-частицы тратили на то, чтобы выбрасывать электроны, которые ионизировали окружающие атомы.
Марсден под руководством Гейгера стал делать свои наблюдения и скоро заметил, что большинство α-частиц проходит через материю, но все же существует заметное рассеяние, а некоторые частицы как бы отскакивают назад. Когда это узнал Резерфорд, он сказал:— Это невозможно.Это так же невозможно, как для пули невозможно отскочить от бумаги. Эта фраза показывает, как конкретно и образно он видел явление.

Марсден и Гейгер опубликовали свою работу, а Резерфорд сразу решил, что существующее представление об атоме неправильно и его надо в корне пересмотреть.Изучая закон распределения отразившихся α-частиц, Резерфорд постарался определить, какое распределение поля внутри атома необходимо, чтобы определить закон рассеивания, при котором α-частицы могут даже возвращаться обратно. Он пришел к выводу, что это возможно тогда, когда весь заряд сосредоточен не по всему объему атома, а в центре. Размер этого центра, названного им ядром, очень мал: 10–12—10–13см в диаметре.
Но куда же тогда поместить электроны?Резерфорд решил, что отрицательно заряженные электроны надо распределить кругом — они могут удерживаться благодаря вращению, центробежная сила которого уравновешивает силу притяжения положительного заряда ядра. Следовательно, модель атома есть не что иное, как некая солнечная система, состоящая из ядра — солнца и электронов — планет. Так он создал свою модель атома.
Эта модель встретила полное недоумение, так как она противоречила некоторым тогдашним, казавшимся незыблемыми, основам физики.П.Л. Капица. «Воспоминания о профессоре Э. Резерфорде»1909–1911 г.Опыты Г.

Гейгера и Э. Марсдена1 – источник α-частиц, 3 – золотая фольга, 5 – микроскоп для наблюдения сцинтилляций, 7 – сцинтиллятор ZnSГ. Гейгер и Э.Марсден увидели, что при прохождении через тонкую фольгу из золота большинство α-частиц, как и ожидалось, пролетает без отклонения, но неожиданно было обнаружено, что часть α-частиц отклоняется на очень большие углы.
Некоторые α-частицы рассеивались даже в обратном направлении. Расчеты напряженности электрического поля атомов в моделях Томсона и Резерфорда показывают существенное различие этих моделей.Напряжённость поля положительного заряда распределенного по поверхности атома в случае модели Томсона ~1013 В/м. В модели Резерфорда положительный заряд, находящийся в центре атома в области R < 10-12см создаёт напряженности поля на 8 порядков больше.
Только такое сильное электрического поле массивного заряженного тела может отклонить α-частицы на большие углы, в то время как в слабом электрическом поле модели Томсона это было невозможно.Э. Резерфорд, 1911 г.»Хорошо известно, что α- и β-частицы при столкновении с атомами вещества испытывают отклонение от прямолинейного пути. Это рассеяние гораздо более заметно у β-частиц нежели у α-частиц, т. к.

они обладают значительно меньшими импульсами и энергиями. Поэтому нет сомнения в том, что столь быстро движущиеся частицы проникают сквозь атомы, встречающиеся на их пути, и что наблюдаемые отклонения обусловлены сильным электрическим полем, действующим внутри атомной системы.Обычно предполагалось, что рассеяние пучка α- или β-лучей при прохождении через тонкую пластинку вещества есть результат многочисленных малых рассеяний при прохождении атомов вещества. Однако наблюдения проведенные Гейгером и Марсденом показали, что некоторое количество α-частиц при однократном столкновении испытывают отклонение на угол больше 90°.
Простой расчет показывает, что в атоме должно существовать сильное электрическое поле, чтобы при однократном столкновении создавалось столь большое отклонение».1911 г.Э. Резерфорд. Атомное ядроα + 197Au → α + 197Au Эрнест Резерфорд(1891-1937)Исходя из планетарной модели атома, Резерфорд вывел формулу описывающую рассеяние α-частиц на тонкой фольге из золота, согласующуюся с результатами Гейгера и Марсдена. Резерфорд предполагал, что α-частицы и атомные ядра с которыми они взаимодействуют можно рассматривать как точечные массы и заряды и что между положительно заряженными ядрами и α-частицами действуют только электростатические силы отталкивания и что ядро настолько тяжелое по сравнению с α-частицей , что оно не смещается в процессе взаимодействия.
Электроны вращаются вокруг атомного ядра на характерных атомных масштабах ~10-8 см и из-за малой массы не влияют на рассеяние α-частиц.Вначале Резерфорд получил зависимость угла рассеяния θ α-частицы с энергией E от величины прицельного параметра b столкновения с точечным массивным ядром. b − прицельный параметр − минимальное расстояние на которое α-частица подошла бы к ядру, если бы между ними не действовали силы отталкивания, θ − угол рассеяния α-частицы, Z1e − электрический заряд α-частицы, Z2e − электрический заряд ядра.Затем Резерфорд рассчитал, какая доля пучка α-частиц с энергией E рассеивается на угол θ в зависимости от заряда ядра Z2e и заряда α-частицы Z1e. Так исходя из классических законов Ньютона и Кулона была получена знаменитая формула рассеяния Резерфорда.

Основным при получении формулы было предположение, что в атоме находится массивный положительно заряженный центр, размеры которого R < 10-12см.Э.Резерфорд, 1911 г.:»Наиболее простым является предположение, что атом имеет центральный заряд, распределенный по очень малому объему, и что большие однократные отклонения обусловлены центральным зарядом в целом, а не его составными частями. В то же время экспериментальные данные недостаточно точны, чтобы можно было отрицать возможности существования небольшой части положительного заряда в виде спутников, находящихся на некотором расстоянии от центра … Следует отметить, что найденное приближенное значение центрального заряда атома золота (100e) примерно совпадает с тем значением, который имел бы атом золота, состоящий из 49 атомов гелия, несущих каждый заряд 2e. Быть может, это лишь совпадение, но оно весьма заманчиво с точки зрения испускания радиоактивным веществом атомов гелия, несущих две единицы заряда».Дж.Дж.
Томсон и Э. РезерфордЭ. Резерфорд, 1921 г.:»Представление о нуклеарном строении атома первоначально возникло из попыток объяснить рассеяние α-частиц на большие углы при прохождении через тонкие слои материи.
Так как α частицы обладают большою массою и большою скоростью, то эти значительные отклонения были в высшей степени замечательны; они указывали на существование весьма интенсивных электрически! или магнитных полей внутри атомов.Чтобы объяснить эти результаты, необходимо было предположить, что атом состоит из заряженного массивного ядра, весьма малых размеров по сравнению с обычно принятой величиной диаметра атома. Это положительно заряженное ядро содержит большую часть массы атома и окружено на некотором расстоянии известным образом распределенными отрицательными электронами; число которых равняется общему положительному заряду ядра. При таких условиях вблизи ядра должно существовать весьма интенсивное электрическое поле и α-частицы, при встрече с отдельным атомом проходя вблизи от ядра, отклоняются на значительные углы.Допуская, что электрические силы изменяются обратно пропорционально квадрату расстояния в области, прилегающей к ядру, автор получил соотношение, связывающее число α-частиц, рассеянных на некоторый угол с зарядом ядра и энергией α-частицы.

Вопрос о том, является ли атомное число элемента действительной мерой его нуклеарного заряда, настолько важен, что для разрешения его должны быть применены все возможные методы. В настоящее время в кавендишевской лаборатории ведется несколько исследований с целью проверки точности этого соотношения.Два наиболее прямых метода основаны на изучения рассеяния быстрых α- и β-лучей. Первый метод применяется Chadwick’oм, пользующимся новыми приемами; последний – Crowthar’oм.
Результаты, полученные до сих пор Chadwick’oм, вполне подтверждают тождество атомного числа с нуклеарным зарядом в пределах возможной точности эксперимента, которая у Chadwick’a составляет около 1%».Несмотря на то, что комбинация двух протонов и двух нейтронов исключительно устойчивое образование, в настоящее время считается, что α-частицы не входит в состав ядра в качестве самостоятельного структурного образования. В случае α-радиоактивных элементов энергия связи α-частицы больше, чем энергия которую необходимо затратить на то, чтобы по отдельности удалить из ядра два протона и два нейтрона, поэтому α-частица может быть испущена из ядра, хотя она не присутствует в ядре как самостоятельное образование.Предположение Резерфорда о том, что атомное ядро может состоять из какого-то количества атомов гелия или о положительно заряженных спутниках ядра, было вполне естественным объяснением открытой им α радиоактивности. Представления о том, что частицы могут рождаться в результате различных взаимодействий, в это время еще не существовало.
Открытие атомного ядра Э.Резерфордом в 1911 г. и последующее изучение ядерных явлений радикально изменило наше представление об окружающем мире. Обогатило науку новыми концепциями, явилось началом исследования субатомной структуры материи.

Модели строения ядра.
Как пpедставить ядpо? Это непpостой вопpос, и было пpедложено несколько моделей ядpа. Наиболее популяpными и используемыми к настоящему вpемени являются две модели: капельная и оболочечная.
Согласно капельной модели ядpо сpавнивается с каплей жидкости, т.к. между каплей жидкости и ядpом много общего. Главная общая чеpта заключается в том, что взаимодействие между молекулами жидкой капли, как и между нуклонами ядpа, обладает свойством насыщения: каждая молекула окpужена лишь вполне опpеделенным числом соседей. Силы взаимодействия между молекулами в капле коpоткодействующие. Объем капли pастет, как и у ядpа, пpопоpционально числу молекул. Сpавнение ядpа с каплей наводит еще на одну важную мысль: капля жидкости обладает повеpхностным натяжением. Есть основание считать, что и ядpо-капля обладает этим свойством. Повеpхностное натяжение стягивает каплю и делает ее шаpообpазной. Поэтому и ядpо, можно сказать, имеет шаpовую фоpму. Имеются и pазличия между каплей жидкости и ядpом атома. Ядpо заpяжено (пpотоны!), капля же обычно нейтpальна (хотя ее специально можно и заpядить). Главное же отличие в том, что капля — классическая система и в ней энеpгия — непpеpывная величина, а ядpо — типично квантовая система и его энеpгия имеет дискpетный спектp.
В оболочечной модели ядpо сpавнивается с атомом, котоpый имеет оболочечную стpуктуpу: центp атома, в котоpом сосpедоточено ядpо, окpужен слоями электpонной оболочки. На пеpвый взгляд кажется, что ядpо ничего общего не должно иметь с атомом, так как в ядpе нет никакого физически выделенного центpа, вокpуг котоpого могли бы pасполагаться слои из нуклонов. Однако нужно учесть квантовую стpуктуpу и ядpа, и атома. Ведь слои электpонной оболочки атома создаются благодаpя тому, что дискpетный энеpгетический спектp атомов таков: его энеpгетические уpовни pаспадаются на pяд сpавнительно близко лежащих гpупп, заполнение уpовней котоpых и составляет слои оболочек из электpонов. Оказалось, что спектpы энеpгии ядеp в этом отношении напоминают спектpы атомов: они также составляют гpуппы близко pасположенных уpовней. Потому постепенное заполнение нуклонами этих гpупп уpовней напоминает электpонные слои атомов. Так стpоится оболочечная модель ядеp.
Ядерные силы.
Для того, чтобы атомные ядра были устойчивыми, протоны и нейтроны должны удерживаться внутри ядер огромными силами, во много раз превосходящими силы кулоновского отталкивания протонов.
Ядерные силы – силы, действующие между ядерными частицами – нуклонами.
Свойства ядерных сил:
1. Это короткодействующие силы, действуют на расстояниях между нуклонами, порядка 10−15 м, и резко убывают при увеличении расстояния; при расстояниях 1,4 ∙ 10−15 м они уже практически равны 0.
2. Это самые мощные силы из всех, которыми располагает природа, поэтому взаимодействие частиц в ядре часто называют сильными взаимодействиями.
3. Ядерным силам свойственно насыщение, т.е. нуклон взаимодействует не со всеми остальными нуклонами, а лишь с некоторыми ближайшими соседями.
4. Ядерным силам свойственна зарядовая независимость. Это значит, что с одинаковой по модулю силой притягиваются друг к другу и заряженные, и незаряженные частицы, т.е. сила притяжения Fрр между двумя протонами равна силе притяжения Fпп между двумя нейтронами и равна силе притяжения Fрп между протоном и нейтроном.
5. Ядерные силы не являются центральными, т.е. они не направлены вдоль прямой, соединяющей центры этих зарядов.
6. Ядерные силы являются так называемыми обменными силами.
Напоминаю, что различают четыре вида фундаментальных взаимодействий в природе: сильное, электромагнитное, слабое и гравитационное.
Сильное взаимодействие происходит на уровне атомных ядер и представляет собой взаимное притяжение и отталкивание их составных частей. Оно действует на расстоянии порядка 10-13 см. При определенных условиях сильное взаимодействие очень прочно связывает частицы, в результате чего образуются материальные системы с высокой энергией связи — атомные ядра. Именно по этой причине ядра атомов являются весьма устойчивыми, их трудно разрушить.
Электромагнитное взаимодействие примерно в тысячу раз слабее сильного, но значительно более дальнодействующее. Взаимодействие такого типа свойственно электрически заряженным частицам. Носителем электромагнитного взаимодействия является не имеющий заряда фотон — квант электромагнитного поля. В процессе электромагнитного взаимодействия электроны и атомные ядра соединяются в атомы, атомы — в молекулы. В определенном смысле это взаимодействие является основным в химии и биологии.
Слабое взаимодействие возможно между различными частицами. Оно простирается на расстояние порядка 10-15 — 10-22 см и связано главным образом с распадом частиц, например, с происходящими в атомном ядре превращениями нейтрона в протон, электрон и антинейтрино. В соответствии с современным уровнем знаний большинство частиц нестабильны именно благодаря слабому взаимодействию.
Гравитационное взаимодействие — самое слабое, не учитываемое в теории элементарных частиц, поскольку на характерных для них расстояниях порядка 10-13 см оно дает чрезвычайно малые эффекты. Однако на ультрамалых расстояниях (порядка 10-33 см) и при ультрабольших энергиях гравитация вновь приобретает существенное значение. Здесь начинают проявляться необычные свойства физического вакуума. Сверхтяжелые виртуальные частицы создают вокруг себя заметное гравитационное поле, которое начинает искажать геометрию пространства. В космических масштабах гравитационное взаимодействие имеет решающее значение. Радиус его действия не ограничен.
Все четыре взаимодействия необходимы и достаточны для построения разнообразного мира.
Без сильных взаимодействий не существовали бы атомные ядра, а звезды и Солнце не могли бы генерировать за счет ядерной энергии теплоту и свет.
Без электромагнитных взаимодействий не было бы ни атомов, ни молекул, ни макроскопических объектов, а также тепла и света.
Без слабых взаимодействий не были бы возможны ядерные реакции в недрах Солнца и звезд, не происходили бы вспышки сверхновых звезд и необходимые для жизни тяжелые элементы не могли бы распространиться во Вселенной. Без гравитационного взаимодействия не только не было бы галактик, звезд, планет, но и вся Вселенная не могла бы эволюционировать, поскольку гравитация является объединяющим фактором, обеспечивающим единство Вселенной как целого и ее эволюцию.
Современная физика пришла к выводу, что все четыре фундаментальных взаимодействия, необходимые для создания из элементарных частиц сложного и разнообразного материального мира, можно получить из одного фундаментального взаимодействия — суперсилы. Наиболее ярким достижением стало доказательство того, что при очень высоких температурах (или энергиях) все четыре взаимодействия объединяются в одно.
Это предположение носит чисто теоретический характер, поскольку экспериментальным путем его проверить невозможно. Косвенно эти идеи подтверждаются астрофизическими данными, которые можно рассматривать как экспериментальный материал, накопленный Вселенной.
Открытие нейтрона и протона.
К 20-м годам XX века физики уже не сомневались в том, что атомные ядра, открытые Э. Резерфордом в 1911 г., также как и сами атомы, имеют сложную структуру. В этом их убеждали многочисленные экспериментальные факты, накопленные к этому времени: открытие радиоактивности, экспериментальное доказательство ядерной модели ядра, измерение отношения e / m для электрона, α-частицы и для так называемой H-частицы – ядра атома водорода, открытие искусственной радиоактивности и ядерных реакций, измерение зарядов атомных ядер и т. д. В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц – протонов и нейтронов.
Первая из этих частиц представляет собой атом водорода, из которого удален единственный электрон. Эта частица наблюдалась уже в опытах Дж. Томсона (1907 г.), которому удалось измерить у нее отношение e / m. В 1919 году Э. Резерфорд обнаружил ядра атома водорода в продуктах расщепления ядер атомов многих элементов. Резерфорд назвал эту частицу протоном. Он высказал предположение, что протоны входят в состав всех атомных ядер.

Схема опытов Резерфорда по обнаружению протонов в продуктах расщепления ядер. К – свинцовый контейнер с радиоактивным источником α-частиц, Ф – металлическая фольга, Э – экран, покрытый сульфидом цинка, М – микроскоп.
Прибор Резерфорда состоял из вакуумированной камеры, в которой был расположен контейнер К с источником α-частиц. Окно камеры было закрыто металлической фольгой Ф, толщина которой была подобрана так, чтобы α-частицы не могли через нее проникнуть. За окном располагался экран Э, покрытый сернистым цинком. С помощью микроскопа М можно было наблюдать сцинтилляции в точках попадания на экран тяжелых заряженных частиц. При заполнении камеры азотом при низком давлении на экране возникали световые вспышки, указывающие на появление потока каких-то частиц, способных проникать через фольгу Ф, практически полностью задерживающую поток α-частиц.
Отодвигая экран Э от окна камеры, Резерфорд измерил среднюю длину свободного пробега наблюдаемых частиц в воздухе. Она оказалась приблизительно равной 28 см, что совпадало с оценкой длины пробега H-частиц, наблюдавшихся ранее Дж. Томсоном. Исследования действия на частицы, выбиваемые из ядер азота, электрических и магнитных полей показали, что эти частицы обладают положительным элементарным зарядом и их масса равна массе ядра атома водорода. Впоследствии опыт был выполнен с целым рядом других газообразных веществ. Во всех случаях было обнаружено, что из ядер этих веществ α-частицы выбивают H-частицы или протоны. По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1,60217733·10–19 Кл, то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10–22. Такое совпадение зарядов двух непохожих друг на друга частиц вызывает удивление и остается одной из фундаментальных загадок современной физики.
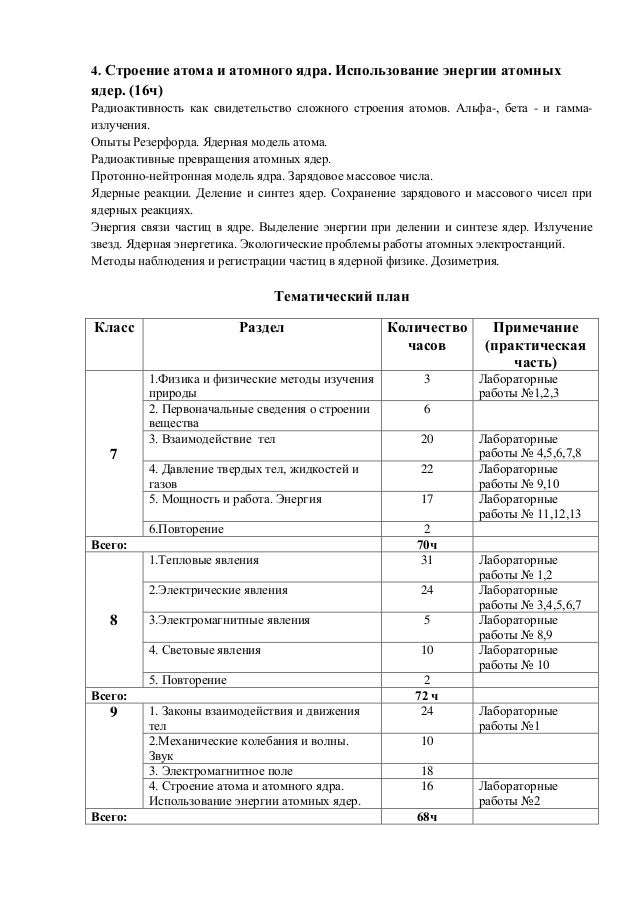
Масса протона, по современным измерениям, равна mp = 1,67262·10–27 кг. В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м.), равной 1/12 массы атома углерода с массовым числом 12:
1 а. е. м. = 1,66057·10–27 кг.
Следовательно, mp = 1,007276 · а. е. м. Во многих случаях массу частицы удобно выражать в эквивалентных значениях энергии в соответствии с формулой E = mc2. Так как 1 эВ = 1,60218·10–19 Дж, в энергетических единицах масса протона равна 938,272331 МэВ. Таким образом, в опыте Резерфорда было открыто явление расщепления ядер азота и других элементов при ударах быстрых α-частиц и показано, что протоны входят в состав ядер атомов. После открытия протона было высказано предположение, что ядра атомов состоят из одних протонов. Однако это предположение оказалось несостоятельным, так как отношение заряда ядра к его массе не остается постоянным для разных ядер, как это было бы, если бы в состав ядер входили одни протоны. Для более тяжелых ядер это отношение оказывается меньше, чем для легких, то есть при переходе к более тяжелым ядрам масса ядра растет быстрее, чем заряд. В 1920 г. Резерфорд высказал гипотезу о существовании в составе ядер жестко связанной компактной протон-электронной пары, представляющей собой электрически нейтральное образование – частицу с массой, приблизительно равной массе протона. Он даже придумал название этой гипотетической частице – нейтрон.
Это была очень красивая, но, как выяснилось впоследствии, ошибочная идея. Электрон не может входить в состав ядра. Квантово-механический расчет на основании соотношения неопределенностей показывает, что электрон, локализованный в ядре, то есть области размером R ≈ 10–13 см, должен обладать колоссальной кинетической энергией, на много порядков превосходящей энергию связи ядер в расчете на одну частицу.
Идея о существовании тяжелой нейтральной частицы казалась Резерфорду настолько привлекательной, что он незамедлительно предложил группе своих учеников во главе с Дж. Чедвиком заняться поиском такой частицы. Через 12 лет в 1932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия α-частицами, и обнаружил, что это излучение представляет собой поток нейтральных частиц с массой, примерно равной массе протона. Так был открыт нейтрон.

При бомбардировке бериллия α-частицами, испускаемыми радиоактивным полонием, возникает сильное проникающее излучение, способное преодолеть такую преграду, как слой свинца толщиной в 10–20 см. Это излучение почти одновременно с Чедвиком наблюдали супруги Жолио-Кюри Ирен и Фредерик (Ирен – дочь Марии и Пьера Кюри), но они предположили, что это γ-лучи большой энергии. Они обнаружили, что если на пути излучения бериллия поставить парафиновую пластину, то ионизирующая способность этого излучения резко возрастает. Они доказали, что излучение бериллия выбивает из парафина протоны, которые в большом количестве имеются в этом водородосодержащем веществе. По длине свободного пробега протонов в воздухе они оценили энергию γ-квантов, способных при столкновении сообщить протонам необходимую скорость.
Она оказалась огромной – порядка 50 МэВ. Дж. Чедвик в 1932 г. выполнил серию экспериментов по всестороннему изучению свойств излучения, возникающего при облучении бериллия α-частицами. В своих опытах Чедвик использовал различные методы исследования ионизирующих излучений. На рис. 2 изображен счетчик Гейгера, предназначенный для регистрации заряженных частиц. Он состоит из стеклянной трубки, покрытой изнутри металлическим слоем (катод), и тонкой нити, идущей вдоль оси трубки (анод). Трубка заполняется инертным газом (обычно аргоном) при низком давлении. Заряженная частица, пролетая в газе, вызывает ионизацию молекул. Появившиеся в результате ионизации свободные электроны ускоряются электрическим полем между анодом и катодом до энергий, при которых начинается ударная ионизация. Возникает лавина ионов, и через счетчик проходит короткий разрядный импульс тока. Другим важнейшим прибором для исследования частиц является так называемая камера Вильсона, в которой быстрая заряженная частица оставляет след (трек). Траекторию частицы можно наблюдать непосредственно или фотографировать.
Действие камеры Вильсона, созданной в 1912 г., основано на конденсации перенасыщенного пара на ионах, образующихся в рабочем объеме камеры вдоль траектории заряженной частицы. С помощью камеры Вильсона можно наблюдать искривление траектории заряженной частицы в электрическом и магнитном полях. Дж. Чедвик в своих опытах наблюдал в камере Вильсона треки ядер азота, испытавших столкновение с бериллиевым излучением. На основании этих опытов он сделал оценку энергии γ-кванта, способного сообщить ядрам азота наблюдаемую в эксперименте скорость. Она оказалась равной 100–150 МэВ. Такой огромной энергией не могли обладать γ-кванты, испущенные бериллием. На этом основании Чедвик заключил, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а достаточно тяжелые частицы.
Поскольку эти частицы обладали большой проникающей способностью и непосредственно не ионизировали газ в счетчике Гейгера, следовательно, они были электронейтральны. Так было доказано существование нейтрона – частицы, предсказанной Резерфордом более чем за 10 лет до опытов Чедвика. Нейтрон – это элементарная частица. Ее не следует представлять в виде компактной протон-электронной пары, как первоначально предполагал Резерфорд. По современным измерениям, масса нейтрона mn = 1,67493·10–27 кг = 1,008665 а. е. м. В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона приблизительно на две электронные массы превосходит массу протона. Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая полностью подтвердилась последующими исследованиями.
Ядро состоит из нуклонов: протонов и нейтронов.
Г. Мозли (Англия) установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Менделеева. Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов.
Масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома. Массовое число атома (A) = Число протонов (Z) + Число нейтронов (N) A=Z+N
Протоны и нейтроны, входящие в состав любого ядра, не являются неделимыми элементарными частицами, а состоят из кварков.
 Кварки, в свою очередь, взаимодействуют друг с другом, непрерывно обмениваясь глюонами — переносчиками истинно сильного взаимодействия (оно в тысячи раз сильнее того, которое действует между протонами и нейтронами в ядре). В результате протоны и нейтроны оказываются очень сильно связанными системами, которые невозможно разбить на составные части.
Кварки, в свою очередь, взаимодействуют друг с другом, непрерывно обмениваясь глюонами — переносчиками истинно сильного взаимодействия (оно в тысячи раз сильнее того, которое действует между протонами и нейтронами в ядре). В результате протоны и нейтроны оказываются очень сильно связанными системами, которые невозможно разбить на составные части.
Энергия связи нуклонов в ядре, дефект массы.
Устойчивость атомного ядра характеризуется энергией связи (Есв.).
Точнейшие измерения показывают, что масса покоя ядра М всегда меньше суммы масс покоя составляющих ее протонов и нейтронов: Мя< Zmp+ Nmn.
Дефект масс — величина, на которую уменьшается масса всех нуклонов при образовании из них атомного ядра. Дефект масс равен разности между суммой масс покоя нуклонов и массой ядра Мя: ∆М= — Мя, где mp, mn — массы протона и нейтрона, соответственно.
Энергия связи – минимальная энергия, которую необходимо затратить для полного расщепления ядра на отдельные нуклоны или энергия, выделяющаяся при слиянии свободных нуклонов в ядро. Расчетная формула энергии связи:
Е св=∆mc2= c2 , где с=3·108 м/с – скорость света в вакууме.
Если в этой формуле массы протона, нейтрона и ядра выражены в килограммах, а скорость света — в метрах в секунду, то энергия связи Есв будет измерена в джоулях. Однако в физике атома и атомного ядра энергию ядер и элементарных частиц чаще выражают в мегаэлектрон-вольтах (МэВ): 1 МэВ = 1,6·10- 13 Дж.
Решая соответствующие задачи, можно получить энергию связи в джоулях, а затем, если требуется, перевести ее в мегаэлектрон-вольты, разделив полученное число джоулей на 1,6·10- 13. Но гораздо проще получить значение энергии связи в мегаэлектрон-вольтах, если оставить массы протона, нейтрона и ядра выраженными в атомных единицах массы и умножить дефект массы ∆М не на с2, а на число 931. Одной атомной единице массы соответствует энергия связи 931 МэВ. Е св=931· ∆М или Е св=931(Zmp + Nmn — Мя) МэВ
Энергия связи переходит в энергию излучаемых при ядерных превращениях γ-квантов, которая равна как раз Есв, а масса которых: ∆М = Е /с2.
Если в результате реакции Е=∆Мc2 > 0, то энергия выделяется, если Е=∆М c2 < 0 — поглощается.
Для характеристики прочности ядра используется величина, которая называется удельной энергией связи εсв.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра, равна отношению энергии связи Есв к массовому числу ядра атома А: εсв=Есв/А, Удельная энергия связи определяется экспериментально.
Ядерные реакции — процессы, происходящие при столкновении ядер или элементарных частиц с другими ядрами, в результате которых изменяются квантовое состояние и нуклонный состав исходного ядра, а также появляются новые частицы среди продуктов реакции.
При этом возможны реакции деления, когда ядро одного атома в результате бомбардировки делится на два ядра разных атомов. При реакциях синтеза происходит превращение легких ядер в более тяжелые.
ВНИМАНИЕ: Разница между химическими и ядерными реакциями состоит в том, что в химических реакциях общее число атомов каждого определенного элемента, а также атомы, составляющие определенные вещества, остаются неизменными. В ядерных реакциях изменяются и атомы, и элементы.
Изотопы.
Изотопы — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число протонов Z и различное число нейтронов n. Изотопы занимают одно и то же место в периодической системе элементов, откуда и произошло их название. По своим ядерным свойствам изотопы, как правило, существенно отличаются. Химические (и почти в той же мере физические) свойства изотопов одинаковы. Это объясняется тем, что химические свойства элемента определяются зарядом ядра, поскольку именно он влияет на структуру электронной оболочки атома.
Исключением являются изотопы легких элементов. Изотопы водорода 1Н — протий, 2Н — дейтерий, 3Н — тритий столь сильно отличаются по массе, что и их физические и химические свойства различны. Дейтерий стабилен (т. е. не радиоактивен) и входит в качестве небольшой примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода. Она при нормальном атмосферном давлении кипит при 101,2°С и замерзает при 3,8°С. Тритий β-радиоактивен с периодом полураспада около 12 лет.
У всех химических элементов имеются изотопы. У некоторых элементов имеются только нестабильные (радиоактивные) изотопы. Для всех элементов искусственно получены радиоактивные изотопы. В атомной индустрии все возрастающую ценность для человечества представляют радиоактивные изотопы.
Радиоактивный распад
Субтитры
Все, что мы до сих пор обсуждали, изучая химию, основывалось на стабильности электронов, и на том, где они, скорее всего, находятся в устойчивых оболочках. Но если продолжить изучение атома, выяснится, что в атоме находятся и действуют не только электроны. Взаимодействия происходят в самом ядре, ему свойственна нестабильность, которую оно стремится ослабить. Это и станет темой нашего видеоурока. На самом деле, изучение этих механизмов не входит в программу по химии для первокурсников, но лишними эти знания точно не будут. Когда мы будем изучать сильные ядерные взаимодействия, квантовую физику и тому подобное, мы еще подробно рассмотрим, почему протоны, нейтроны и кварки, из которых состоят ядра атомов, взаимодействуют именно таким образом. А сейчас представим, каким образом ядро вообще может распадаться.. Начнем с пучка протонов. Я нарисую несколько. Это протоны, а тут будут нейтроны. Нарисую их каким-нибудь подходящим цветом. Серый цвет – то, что надо. Итак, вот они, мои нейтроны. Сколько у меня протонов? У меня 1, 2, 3, 4, 5, 6, 7, 8. Значит, будет 1, 2, 3, 4, 5, 6, 7, 8, 9 нейтронов. Допустим, это ядро атома. Это, кстати, самый первый ролик об атомном ядре. Вообще, нарисовать атом, на самом деле, очень трудно, ведь у него нет четко определенных границ. Электрон в любой момент времени может находиться где угодно. Но если говорить о месте нахождения электрона 90% времени, то им будет радиус или диаметр атома. Мы уже давно знаем, что ядро — это бесконечно малая часть объема той сферы, где электрон находится 90% времени. А из этого следует что практически все, что мы видим вокруг, это пустое пространство. Все это — пустое пространство. Я говорю об этом, потому что это бесконечно малое пятнышко, даже несмотря на то, что оно является очень малой долей объема атома, его масса составляет почти всю массу атома — это очень важно. Это не атомы, это не электроны. Мы проникаем в ядро. Оказывается, иногда ядро бывает нестабильно и стремится достичь более устойчивой конфигурации. Мы не будем углубляться в детали причин неустойчивости ядра. Но, просто скажу, что иногда оно испускает так, называемые альфа-частицы. Это явление называется альфа-распадом. Запишем. Альфа-распад. Ядро испускает альфа-частицу, звучит фантастично. Это просто совокупность нейтронов и протонов. А альфа-частица – это два нейтрона и два протона. Возможно, они чувствуют, что они здесь не помещаются, вот эти, например. И происходит эмиссия. Они покидают ядро. Рассмотрим, что происходит с атомом, когда случается что-то подобное. Возьмем случайный элемент, назовем его Е. У него есть P — протоны. Нарисую буквы таким же цветом, что и протоны. Итак, вот — протоны. Естественно, у элемента Е есть массовое число атома, равное сумме протонов и нейтронов. Нейтроны серые. Происходит альфа-распад, что же будет с этим элементом? Что же будет с этим элементом? Количество протонов уменьшается на два. Поэтому количество протонов составит р минус 2. И число нейтронов тоже уменьшается на два. Итак, здесь у нас р минус 2, плюс наши нейтроны минус 2, то есть, всего минус 4. Масса уменьшается на четыре, и прежний элемент превращается в новый. Помните, что элементы определяются количеством протонов. При альфа-распаде вы теряете два нейтрона и два протона, но именно протоны превращают этот элемент в другой. Если мы назовем этот элемент 1, что я и собираюсь сделать, то теперь у нас будет новый элемент, элемент 2. Смотрите внимательно. Происходит эмиссия чего-то, что имеет два протона, и два нейтрона. Поэтому его масса будет равна массе двух протонов и двух нейтронов. Что же это? Отделяется что-то, имеющее массу четыре. Что содержит два протона и два нейтрона? Сейчас у меня нет периодической системы элементов. Я забыл ее вырезать и вставить перед съемкой этого видеоролика. Но вы быстро найдете в периодической таблице элемент, имеющий два протона, и этот элемент – гелий. Его атомная масса действительно четыре. Действительно, при альфа-распаде происходит эмиссия именно ядра гелия. Это ядро гелия. Так как это ядро гелия, у него нет электронов, чтобы нейтрализовать заряд протонов, это ион. У него нет электронов. У него только два протона, поэтому он имеет заряд плюс 2. Подпишем заряд. Альфа-частица – это просто ион гелия, ион гелия с зарядом плюс 2, самопроизвольно испускаемый ядром для достижения более устойчивого состояния. Это один вид распада. Теперь другие.. Рисуем еще одно ядро. Нарисую нейтроны. Нарисую протоны. Иногда получается так, что нейтрон чувствует себя неуютно. Он каждый день смотрит на то, что делают протоны, и говорит, знаете, что? Почему-то, когда я прислушиваюсь к себе, я чувствую, что на самом деле должен быть протоном. Если бы я был протоном, все ядро было бы немного устойчивее. И что он делает, чтобы стать протоном? Помните, нейтрон имеет нейтральный заряд? Вот что он делает, он испускает электрон. Это кажется сумасшествием. Электроны в нейтронах и все такое. И я согласен с вами. Это сумасшествие. И однажды мы изучим все, что находится внутри ядра. А пока просто скажем, что нейтрон может испустить электрон. Что он и делает. Итак, вот электрон. Мы принимаем его массу за равную нулю.. На самом деле это не так, но мы говорим сейчас о единицах атомной массы. Если масса протона – один, то масса электрона в 1836 раз меньше. Поэтому мы принимаем его массу за ноль. Хоть это и не так. А его заряд – минус 1. Итак, вернемся к процессу. Нейтрон испускает электрон. Конечно, нейтрон не остается нейтральным, а превращается в протон. Это называется бета-распадом. Запишем этот вид. Бэта-распад. А бета-частица – на самом деле просто испускаемый электрон. Вернемся к нашему элементу. У него есть определенное количество протонов и нейтронов. Вместе они составляют массовое число. Что происходит, когда он подвергается бета-распаду? Изменяется ли количество протонов? Конечно, у нас на один протон больше, чем было, потому что один нейтрон превратился в протон. Количество протонов увеличилось на 1. Изменилось ли массовое число? Посмотрим. Количество нейтронов уменьшилось на один, а количество протонов увеличилось на один. Поэтому массовое число не изменилось. Оно по-прежнему составляет Р плюс N, то есть, масса остается неизменной, в отличие от ситуации с альфа-распадом, но сам элемент изменяется. Количество протонов изменяется. В результате бета-распада мы снова получаем новый элемент. Теперь другая ситуация. Допустим, один из этих протонов смотрит на нейтроны и говорит, знаете, что? Я вижу, как они живут. Мне это очень нравится. Думаю, мне было бы удобнее, а наша группа частиц внутри ядра была бы счастливее, если бы я тоже был нейтроном. Все мы находились бы в более устойчивом состоянии. И что он делает? У этого испытывающего неудобства протона есть возможность испустить позитрон, а не протон. Он испускает позитрон. А что это такое? Это частица, которая имеет точно такую же массу, как и электрон. То есть, его масса в 1836 раз меньше массы протона. Но здесь мы пишем просто ноль, потому что в единицах атомной массы она приближается к нулю. Но позитрон имеет положительный заряд. Немного путает то, что здесь все еще написано е. Когда я вижу е, я думаю, что это электрон. Но нет, эту частицу обозначают буквой е, потому что это частица того же типа, но, вместо отрицательного заряда, она имеет положительный заряд. Это позитрон. Подпишем. Начинает происходить что-то необычное с этими типами частиц и веществом, которые мы рассматриваем. Но это — факт. И если протон испускает эту частицу, то с ней практически уходит его положительный заряд, и этот протон превращается в нейтрон. Это называется эмиссией позитрона. Эмиссию позитрона представить довольно легко, В названии все сказано. Снова элемент Е, с определенным количеством протонов, и нейтронов. Каким должен быть этот новый элемент? Он теряет протон. P минус 1. Он превращается в нейтрон. То есть, количество P уменьшается на один. Количество N увеличивается на один. Поэтому масса целого атома не изменяется. Она составит P плюс N. Но у нас все еще должен получиться другой элемент, правильно? Когда происходит бета-распад, увеличивается количество протонов. Мы переместились вправо в периодической таблице, или увеличили, вы знаете, что я имею в виду. Когда происходит эмиссия позитрона, уменьшается количество протонов. Нужно это записать в обеих этих реакциях. Итак, это эмиссия позитрона, и остается один позитрон. А в нашем бета-распаде остается один электрон. Реакции записаны абсолютно одинаково. Вы знаете, что это электрон, потому что он имеет заряд минус 1. Вы знаете, что это позитрон, потому что он имеет заряд плюс 1. Остается один, последний тип распада, о котором вы должны знать. Но он не изменяет количество протонов или нейтронов в ядре. Он просто высвобождает огромное количество энергии, или, иногда, высокоэнергетический протон. Это явление называется гамма-распадом. Гамма-распад означает, что эти частицы меняют свою конфигурацию. Они немного сближаются. И сближаясь, выделяют энергию в виде электромагнитного излучения с очень маленькой длиной волны. По существу, можно называть это гамма- частицей или гамма-лучом. Это сверхвысокая энергия. Гамма-лучи очень опасны. Они могут вас убить. Все это была теория. Теперь решим пару задач и выясним, с каким типом распада мы имеем дело. Здесь у меня бериллий-7, где семь — это атомная масса. И я превращаю его в литий-7. Итак, что здесь происходит? Масса ядра бериллия остается неизменной, но количество протонов уменьшается с четырех до трех. Уменьшилось количество протонов бериллия. Общая масса не изменилась. Несомненно, это не альфа-распад. Альфа-распад, как вы знаете, это выделение гелия из ядра. Так что же выделяется? Выделяется положительный заряд, или позитрон. Здесь это показано с помощью уравнения. Это позитрон. Поэтому этот тип распада бериллия-7 до лития-7- это эмиссия позитрона. Все ясно. А теперь взглянем на следующий пример. Уран-238, распадающийся до тория-234. И мы видим, что атомная масса уменьшается на 4, и видим, что атомное число уменьшается, количество протонов уменьшается на 2. Вероятно, выделилось что-то, что имеет атомную массу четыре, и атомное число два, то есть, гелий. Значит это альфа-распад. Вот здесь – это альфа-частица. Это пример альфа-распада. Но тут не все так просто. Потому что, если из 92 протонов осталось 90 протонов, здесь осталось еще 92 электрона. Будет ли теперь заряд минус 2? И более того, гелий, который высвобождается, он же не имеет электронов. Это просто ядро гелия. Так будет ли заряд плюс 2? Задавая такой вопрос, вы будете абсолютно правы. Но на самом деле именно в момент распада у тория больше нет причин удерживать эти два электрона, поэтому эти два электрона исчезают, и торий опять становится нейтральным. А гелий очень быстро реагирует таким же образом. Ему очень нужны два электрона для устойчивости, поэтому он очень быстро захватывает два электрона и становится стабильным. Можно записать это любым способом. Рассмотрим еще один пример. Здесь у меня йод. Хорошо. Посмотрим, что происходит. Масса не изменяется. Протоны должны превратиться в нейтроны или нейтроны – превратиться в протоны. Мы видим, тут у меня 53 протона, а здесь — 54. Видимо, один нейтрон превратился в протон. Нейтрон, видимо, превратился в протон. А нейтрон превращается в протон, испуская электрон. И мы наблюдаем это во время этой реакции. Электрон высвободился. Значит, это бета-распад. Это бета-частица. Подписали. Действует та же логика. Подождите, вместо 53 стало 54 протона. Теперь, когда прибавился еще один протон, будет ли у меня положительный заряд? Да, будет. Но очень скоро – возможно, не именно эти электроны, вокруг вращается так много электронов – я захвачу электроны из какого-нибудь места, чтобы стать устойчивым, и снова обрету устойчивость. Но вы будете абсолютно правы, если зададите вопрос, не станет ли частица ионом на малую долю времени? Рассмотрим еще один пример. Радон-222 с атомным числом 86, который превращается в полоний -218, с атомным числом 84. Небольшое интересное отступление. Полоний назван так в честь Польши, потому что Мария Кюри, открывшая его, оттуда, в то время, примерно в конце 1800-х годов – Польша еще не существовала как отдельная страна. Ее территория была разделена между Пруссией, Россией и Австрией. И поляки очень хотели, чтобы люди знали – они – единый народ. Они сделали открытие, что, когда радон подвергается распаду, образуется этот элемент. И назвали его в честь своей родины, Польши. Это привилегия открытия новых элементов. Но вернемся к задаче. Итак, что произошло? Атомная масса уменьшилась на четыре. Атомное число уменьшилось на два. Еще раз повторю, видимо, высвободилась частица гелия. Ядро гелия имеет атомную массу четыре и атомное число два. Все ясно. Значит, это альфа-распад. Можно написать, что это ядро гелия. Оно не имеет электронов. Мы можем даже сразу сказать, что оно будет иметь отрицательный заряд, но затем оно его теряет. Subtitles by the Amara.org community
Ядерная физика

Атомное ядро · Радиоактивный распад · Ядерная реакция · Термоядерная реакция
Основные термины
Сложный распад
Излучения
Захваты
Электронный захват · Нейтронный захват (r-процесс · s-процесс) · Протонный захват (p-процесс · rp-процесс) · Нейтронизация
Известные учёные
Беккерель · Бете · Бор · Гейзенберг · Кюри М. · Кюри П. · Резерфорд · Содди · Уилер · Ферми
См. также: Портал:Физика
Радиоакти́вный распа́д (от лат. radius «луч» и āctīvus «действенный», через фр. radioactif, букв. — «радиоактивность») — спонтанное изменение состава (заряда Z, массового числа A) или внутреннего строения нестабильных атомных ядер (нуклидов) путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие нуклиды — радиоактивными (радионуклидами). Радиоактивными называют также вещества, содержащие радиоактивные ядра.
Теория
Естественная радиоактивность — самопроизвольный распад атомных ядер, встречающихся в природе.
Искусственная радиоактивность — самопроизвольный распад атомных ядер, полученных искусственным путём через соответствующие ядерные реакции.
Ядро, испытывающее радиоактивный распад, и ядро, возникающее в результате этого распада, называют соответственно материнским и дочерним ядрами. Изменение массового числа и заряда дочернего ядра по отношению к материнскому описывается правилом смещения Содди.
Распад, сопровождающийся испусканием альфа-частиц, назвали альфа-распадом; распад, сопровождающийся испусканием бета-частиц, был назван бета-распадом (в настоящее время известно, что существуют типы бета-распада без испускания бета-частиц, однако бета-распад всегда сопровождается испусканием нейтрино или антинейтрино). Термин «гамма-распад» применяется редко; испускание ядром гамма-квантов называют обычно изомерным переходом. Гамма-излучение часто сопровождает другие типы распада, когда в результате первого этапа распада возникает дочернее ядро в возбуждённом состоянии, затем испытывающее переход в основное состояние с испусканием гамма-квантов.
Энергетические спектры α-частиц и γ-квантов, излучаемых радиоактивными ядрами, прерывистые («дискретные»), а спектр β-частиц — непрерывный.
В настоящее время, кроме альфа-, бета- и гамма-распадов, обнаружены распады с испусканием нейтрона, протона (а также двух протонов), кластерная радиоактивность, спонтанное деление. Электронный захват, позитронный распад (или β+-распад), а также двойной бета-распад (и его виды) обычно считаются различными типами бета-распада.
Некоторые изотопы могут испытывать одновременно два или более видов распада. Например, висмут-212 распадается с вероятностью 64 % в таллий-208 (посредством альфа-распада) и с вероятностью 36 % в полоний-212 (посредством бета-распада).
Образовавшееся в результате радиоактивного распада дочернее ядро иногда оказывается также радиоактивным и через некоторое время тоже распадается. Процесс радиоактивного распада будет происходить до тех пор, пока не появится стабильное, то есть нерадиоактивное ядро. Последовательность таких распадов называется цепочкой распадов, а последовательность возникающих при этом нуклидов называется радиоактивным рядом. В частности, для радиоактивных рядов, начинающихся с урана-238, урана-235 и тория-232, конечными (стабильными) нуклидами являются соответственно свинец-206, свинец-207 и свинец-208.
Ядра с одинаковым массовым числом A (изобары) могут переходить друг в друга посредством бета-распада. В каждой изобарной цепочке содержится от 1 до 3 бета-стабильных нуклидов (они не могут испытывать бета-распад, однако не обязательно стабильны по отношению к другим видам радиоактивного распада). Остальные ядра изобарной цепочки бета-нестабильны; путём последовательных бета-минус- или бета-плюс-распадов они превращаются в ближайший бета-стабильный нуклид. Ядра, находящиеся в изобарной цепочке между двумя бета-стабильными нуклидами, могут испытывать и β−-, и β+-распад (или электронный захват). Например, существующий в природе радионуклид калий-40 способен распадаться в соседние бета-стабильные ядра аргон-40 и кальций-40:
19 40 K + e − → 18 40 Ar + ν e , {\displaystyle {}_{19}^{40}{\textrm {K}}+e^{-}\rightarrow {}_{18}^{40}{\textrm {Ar}}+\nu _{e},}

Радиоактивность природных элементов
Экспериментально установлено, что радиоактивны, то есть не имеют стабильных изотопов, все химические элементы с порядковым номером, большим 82 (то есть начиная с висмута).
Все более лёгкие элементы, помимо стабильных изотопов, имеют радиоактивные изотопы с разными периодами полураспада, варьирующимися от долей наносекунды до значений, на много порядков превышающих возраст Вселенной. Например, теллур-128 имеет самый долгий измеренный период полураспада из всех изученных радионуклидов, ~2,2·1024 лет.
Исключение по нестабильности из элементов легче висмута составляют прометий и технеций, не имеющие долгоживущих относительно длительности геологических эпох изотопов. Наиболее долгоживущий изотоп технеция — технеций-98 — имеет период полураспада около 4,2 млн лет, а самый долгоживущий изотоп прометия — прометий-145 — 17,5 лет. Поэтому изотопы технеция и прометия со времени формирования Земли не сохранились в земной коре и получены искусственно.
Существует много природных радиоактивных изотопов, период полураспада которых соизмерим с возрастом Земли или многократно превышает его, поэтому, несмотря на их радиоактивность, эти изотопы содержатся в природной изотопной смеси соответствующих элементов. Примерами могут служить калий-40, рений-187, рубидий-87, теллур-128 и многие другие.
Измерение отношения концентраций некоторых из долгоживущих изотопов и продуктов их распада позволяет проводить абсолютную датировку минералов, горных пород и метеоритов в геологии.
История открытия
Радиоактивность была открыта в 1896 году французским физиком А. Беккерелем. Он занимался исследованием связи люминесценции и недавно открытых рентгеновских лучей.
Беккерелю пришла в голову мысль: не сопровождается ли всякая люминесценция рентгеновскими лучами? Для проверки своей догадки он взял несколько соединений, в том числе одну из солей урана, фосфоресцирующую жёлто-зелёным светом. Осветив её солнечным светом, он завернул соль в чёрную бумагу и положил в тёмном шкафу на фотопластинку, тоже завёрнутую в чёрную бумагу. Через некоторое время, проявив пластинку, Беккерель действительно увидел изображение куска соли. Но люминесцентное излучение не могло пройти через чёрную бумагу, и только рентгеновские лучи могли в этих условиях засветить пластинку. Беккерель повторил опыт несколько раз и с одинаковым успехом.
24 февраля 1896 года на заседании Французской академии наук он сделал сообщение «Об излучении, производимом фосфоресценцией». Но уже через несколько дней в интерпретацию полученных результатов пришлось внести корректировки. 26 и 27 февраля в лаборатории Беккереля был подготовлен очередной опыт с небольшими изменениями, но из-за облачной погоды он был отложен. Не дождавшись хорошей погоды, 1 марта Беккерель проявил пластинку, на которой лежала урановая соль, так и не облучённая солнечным светом. Она, естественно, не фосфоресцировала, но отпечаток на пластинке получился. Уже 2 марта Беккерель доложил об этом открытии на заседании Парижской Академии наук, озаглавив свою работу «О невидимой радиации, производимой фосфоресцирующими телами».
Впоследствии Беккерель испытал и другие соединения и минералы урана (в том числе не проявляющие фосфоресценции), а также металлический уран. Пластинка неизменно засвечивалась. Поместив между солью и пластинкой металлический крестик, Беккерель получил слабые контуры крестика на пластинке. Тогда стало ясно, что открыты новые лучи, проходящие сквозь непрозрачные предметы, но не являющиеся рентгеновскими.
Беккерель установил, что интенсивность излучения определяется только количеством урана в препарате и совершенно не зависит от того, в какие соединения он входит. Таким образом, это свойство было присуще не соединениям, а химическому элементу — урану.
Своим открытием Беккерель делится с учёными, с которыми он сотрудничал. В 1898 г. Мария Кюри и Пьер Кюри обнаружили радиоактивность тория, позднее ими были открыты радиоактивные элементы полоний и радий.
Они выяснили, что свойством естественной радиоактивности обладают все соединения урана и в наибольшей степени сам уран. Беккерель же вернулся к интересующим его люминофорам. Правда, он сделал ещё одно крупное открытие, относящееся к радиоактивности. Однажды для публичной лекции Беккерелю понадобилось радиоактивное вещество, он взял его у супругов Кюри и положил пробирку в жилетный карман. Прочтя лекцию, он вернул радиоактивный препарат владельцам, а на следующий день обнаружил на теле под жилетным карманом покраснение кожи в форме пробирки. Беккерель рассказал об этом Пьеру Кюри, и тот поставил на себе опыт: в течение десяти часов носил привязанную к предплечью пробирку с радием. Через несколько дней у него тоже появилось покраснение, перешедшее затем в тяжелейшую язву, от которой он страдал в течение двух месяцев. Так впервые было открыто биологическое действие радиоактивности.
Но и после этого супруги Кюри мужественно делали своё дело. Достаточно сказать, что Мария Кюри умерла от лучевой болезни (дожив, тем не менее, до 66 лет).
В 1955 г. были обследованы записные книжки Марии Кюри. Они до сих пор излучают из-за радиоактивного загрязнения, внесённого при их заполнении. На одном из листков сохранился радиоактивный отпечаток пальца Пьера Кюри.
Закон радиоактивного распада
 Моделирование распада многих идентичных атомов. Начиная с 4 атомов (слева) и 400 (справа). Сверху показано число периодов полураспада. Основная статья: Закон радиоактивного распада
Моделирование распада многих идентичных атомов. Начиная с 4 атомов (слева) и 400 (справа). Сверху показано число периодов полураспада. Основная статья: Закон радиоактивного распада
Закон радиоактивного распада — закон, открытый Фредериком Содди и Эрнестом Резерфордом экспериментальным путём и сформулированный в 1903 году. Современная формулировка закона:
d N d t = − λ N , {\displaystyle {\frac {dN}{dt}}=-\lambda N,}
что означает, что число распадов за интервал времени t в произвольном веществе пропорционально числу N имеющихся в образце радиоактивных атомов данного типа.
В этом математическом выражении λ — постоянная распада, которая характеризует вероятность радиоактивного распада за единицу времени и имеет размерность с−1. Знак минус указывает на убывание числа радиоактивных ядер со временем. Закон выражает независимость распада радиоактивных ядер друг от друга и от времени: вероятность распада данного ядра в каждую следующую единицу времени не зависит от времени, прошедшего с начала эксперимента, и от количества ядер, оставшихся в образце.
Этот закон считается основным законом радиоактивности, из него было извлечено несколько важных следствий, среди которых формулировки характеристик распада — среднее время жизни атома и период полураспада.
Константа распада радиоактивного ядра в большинстве случаев практически не зависит от окружающих условий (температуры, давления, химического состава вещества и т. п.). Например, твёрдый тритий T2 при температуре в несколько кельвинов распадается с той же скоростью, что и газообразный тритий при комнатной температуре или при температуре в тысячи кельвинов; тритий в составе молекулы T2 распадается с той же скоростью, что и в составе тритированного валина. Слабые изменения константы распада в лабораторных условиях обнаружены лишь для электронного захвата — доступные в лаборатории температуры и давления, а также изменение химического состава способны несколько изменять плотность электронного облака в окружении ядра, что приводит к изменению скорости распада на доли процента. Однако в достаточно жёстких условиях (высокая ионизация атома, высокая плотность электронов, высокий химический потенциал нейтрино, сильные магнитные поля), труднодостижимых в лаборатории, но реализующихся, например, в ядрах звёзд, другие типы распадов тоже могут изменять свою вероятность.
Постоянство константы радиоактивного распада позволяет измерять возраст различных природных и искусственных объектов по распаду входящих в их состав радиоактивных ядер и накоплению продуктов распада. Разработан ряд методов радиоизотопного датирования, позволяющих измерять возраст объектов в диапазоне от единиц до миллиардов лет; среди них наиболее известны радиоуглеродный метод, уран-свинцовый метод, уран-гелиевый метод, калий-аргоновый метод и др.
Виды частиц, испускаемых при радиоактивном распаде
Э. Резерфорд экспериментально установил (1899), что соли урана испускают лучи трёх типов, которые по-разному отклоняются в магнитном поле:
- лучи первого типа отклоняются так же, как поток положительно заряженных частиц; их назвали α-лучами;
- лучи второго типа обычно отклоняются в магнитном поле так же, как поток отрицательно заряженных частиц, их назвали β-лучами (существуют, однако, позитронные бета-лучи, отклоняющиеся в противоположную сторону);
- лучи третьего типа, которые не отклоняются магнитным полем, назвали γ-излучением.
Хотя в ходе исследований были обнаружены и другие типы частиц, испускающихся при радиоактивном распаде, перечисленные названия сохранились до сих пор, поскольку соответствующие типы распадов наиболее распространены.
При взаимодействии распадающегося ядра с электронной оболочкой возможно испускание частиц (рентгеновских фотонов, Оже-электронов, конверсионных электронов) из электронной оболочки. Первые два типа излучений возникают при появлении в электронной оболочке вакансии (в частности, при электронном захвате и при изомерном переходе с излучением конверсионного электрона) и последующем каскадном заполнении этой вакансии. Конверсионный электрон испускается в процессе изомерного перехода с внутренней конверсией, когда энергия, выделяющаяся при переходе между уровнями ядра, не уносится гамма-квантом, а передаётся одному из электронов оболочки.
При спонтанном делении ядро распадается на два (реже три) относительно лёгких ядра — так называемые осколки деления — и несколько нейтронов. При кластерном распаде (являющемся промежуточным процессом между делением и альфа-распадом) тяжёлым материнским ядром испускается относительно лёгкое ядро (14C, 16O и т. п.).
При протонном (двухпротонном) и нейтронном распаде ядро испускает соответственно протоны и нейтроны.
Во всех типах бета-распада (кроме предсказанного, но пока не открытого безнейтринного) ядром испускается нейтрино или антинейтрино.
Альфа-распад
Основная статья: Альфа-распад
Альфа-распадом называют самопроизвольный распад атомного ядра на дочернее ядро и α-частицу (ядро атома 4He).
Альфа-распад, как правило, происходит в тяжёлых ядрах с массовым числом А ≥ 140 (хотя есть несколько исключений). Внутри тяжёлых ядер за счёт свойства насыщения ядерных сил образуются обособленные α-частицы, состоящие из двух протонов и двух нейтронов. Образовавшаяся α-частица подвержена большему действию кулоновских сил отталкивания от протонов ядра, чем отдельные протоны. Одновременно α-частица испытывает меньшее ядерное притяжение к нуклонам ядра, чем остальные нуклоны. Образовавшаяся альфа-частица на границе ядра отражается от потенциального барьера внутрь, однако с некоторой вероятностью она может преодолеть его (см. Туннельный эффект) и вылететь наружу. С уменьшением энергии альфа-частицы проницаемость потенциального барьера очень быстро (экспоненциально) уменьшается, поэтому время жизни ядер с меньшей доступной энергией альфа-распада при прочих равных условиях больше.
Правило смещения Содди для α-распада:
Z A X → Z − 2 A − 4 Y + 2 4 He . {\displaystyle {}_{Z}^{A}{\textrm {X}}\rightarrow {}_{Z-2}^{A-4}{\textrm {Y}}+{}_{2}^{4}{\textrm {He}}.}
Пример (альфа-распад урана-238 в торий-234):
92 238 U → 90 234 Th + 2 4 He . {\displaystyle {}_{92}^{238}{\textrm {U}}\rightarrow {}_{90}^{234}{\textrm {Th}}+{}_{2}^{4}{\textrm {He}}.}
В результате α-распада атом смещается на 2 клетки к началу таблицы Менделеева (то есть заряд ядра Z уменьшается на 2), массовое число дочернего ядра уменьшается на 4.
Бета-распад
Основная статья: Бета-распад
Бета-минус-распад
Беккерель доказал, что β-лучи являются потоком электронов. Бета-распад — это проявление слабого взаимодействия.
Бета-распад (точнее, бета-минус-распад, β−-распад) — это радиоактивный распад, сопровождающийся испусканием из ядра электрона и электронного антинейтрино.
 Фейнмановская диаграмма бета-минус-распада: d-кварк в одном из нейтронов ядра превращается в u-кварк, испуская виртуальный W-бозон, который распадается в электрон и электронное антинейтрино.
Фейнмановская диаграмма бета-минус-распада: d-кварк в одном из нейтронов ядра превращается в u-кварк, испуская виртуальный W-бозон, который распадается в электрон и электронное антинейтрино.
Бета-распад является внутринуклонным процессом. Бета-минус-распад происходит вследствие превращения одного из d-кварков в одном из нейтронов ядра в u-кварк; при этом происходит превращение нейтрона в протон с испусканием электрона и антинейтрино:
0 1 n → 1 1 p + − 1 0 e + ν ¯ e . {\displaystyle {}_{0}^{1}{\textrm {n}}\rightarrow {}_{1}^{1}{\textrm {p}}+{}_{-1}^{0}{\textrm {e}}+{\bar {\nu }}_{e}.}
Свободные нейтроны также испытывают β−-распад, превращаясь в протон, электрон и антинейтрино (см. Бета-распад нейтрона).
Правило смещения Содди для β−-распада:
Z A X → Z + 1 A Y + − 1 0 e + ν ¯ e . {\displaystyle {}_{Z}^{A}{\textrm {X}}\rightarrow {}_{Z+1}^{A}{\textrm {Y}}+{}_{-1}^{0}{\textrm {e}}+{\bar {\nu }}_{e}.}
Пример (бета-распад трития в гелий-3):
1 3 H → 2 3 He + − 1 0 e + ν ¯ e . {\displaystyle {}_{1}^{3}{\textrm {H}}\rightarrow {}_{2}^{3}{\textrm {He}}+{}_{-1}^{0}{\textrm {e}}+{\bar {\nu }}_{e}.}
После β−-распада элемент смещается на 1 клетку к концу таблицы Менделеева (заряд ядра увеличивается на единицу), тогда как массовое число ядра при этом не меняется.
Позитронный распад и электронный захват
 Фейнмановская диаграмма позитронного распада: u-кварк в одном из протонов ядра превращается в d-кварк, испуская виртуальный W-бозон, который распадается в позитрон и электронное нейтрино.
Фейнмановская диаграмма позитронного распада: u-кварк в одном из протонов ядра превращается в d-кварк, испуская виртуальный W-бозон, который распадается в позитрон и электронное нейтрино. Фейнмановская диаграмма электронного захвата: u-кварк в одном из протонов ядра превращается в d-кварк, испуская виртуальный W-бозон, который взаимодействует с электроном оболочки, превращая его в электронное нейтрино. Основные статьи: Позитронный распад, Электронный захват
Фейнмановская диаграмма электронного захвата: u-кварк в одном из протонов ядра превращается в d-кварк, испуская виртуальный W-бозон, который взаимодействует с электроном оболочки, превращая его в электронное нейтрино. Основные статьи: Позитронный распад, Электронный захват
Существуют также другие типы бета-распада. В позитронном распаде (бета-плюс-распаде) ядро испускает позитрон и электронное нейтрино. При β+-распаде заряд ядра уменьшается на единицу (ядро смещается на одну клетку к началу таблицы Менделеева), то есть один из протонов ядра превращается в нейтрон, испуская позитрон и нейтрино (на кварковом уровне этот процесс можно описать как превращение одного из u-кварков в одном из протонов ядра в d-кварк; следует отметить, что свободный протон не может распасться в нейтрон, это запрещено законом сохранения энергии, т.к. нейтрон тяжелее протона; однако в ядре такой процесс возможен, если разность масс материнского и дочернего атома положительна). Позитронный распад всегда сопровождается конкурирующим процессом — электронным захватом; в этом процессе ядро захватывает электрон из атомной оболочки и испускает нейтрино, при этом заряд ядра также уменьшается на единицу. Однако обратное неверно: для многих нуклидов, испытывающих электронный захват (ε-захват), позитронный распад запрещён законом сохранения энергии. В зависимости от того, с какой из электронных оболочек атома (K, L, M,…) захватывается электрон при ε-захвате, процесс обозначается как К-захват, L-захват, M-захват, …; все они, при наличии соответствующих оболочек и достаточности энергии распада, обычно конкурируют, однако наиболее вероятен К-захват, поскольку концентрация электронов K-оболочки вблизи ядра выше, чем более удалённых оболочек. После захвата электрона образовавшаяся вакансия в электронной оболочке заполняется путём перехода электрона из более высокой оболочки, этот процесс может быть каскадным (после перехода вакансия не исчезает, а смещается на более высокую оболочку), а энергия уносится посредством рентгеновских фотонов и/или оже-электронов с дискретным энергетическим спектром.
Правило смещения Содди для β+-распада и электронного захвата:
Z A X → Z − 1 A Y + e + + ν e . {\displaystyle {}_{Z}^{A}{\textrm {X}}\rightarrow {}_{Z-1}^{A}{\textrm {Y}}+e^{+}+\nu _{e}.}
Пример (ε-захват бериллия-7 в литий-7):
4 7 Be + e − → 3 7 Li + ν e . {\displaystyle {}_{4}^{7}{\textrm {Be}}+e^{-}\rightarrow {}_{3}^{7}{\textrm {Li}}+\nu _{e}.}
После позитронного распада и ε-захвата элемент смещается на 1 клетку к началу таблицы Менделеева (заряд ядра уменьшается на единицу), тогда как массовое число ядра при этом не меняется.
Двойной бета-распад
Основная статья: Двойной бета-распад
Наиболее редким из всех известных типов радиоактивного распада является двойной бета-распад, он обнаружен на сегодня лишь для одиннадцати нуклидов, и период полураспада для любого из них превышает 1019 лет. Двойной бета-распад, в зависимости от нуклида, может происходить:
- с повышением заряда ядра на 2 (при этом испускаются два электрона и два антинейтрино, 2β−-распад)
- с понижением заряда ядра на 2, при этом испускаются два нейтрино и
- два позитрона (двухпозитронный распад, 2β+-распад)
- испускание одного позитрона сопровождается захватом электрона из оболочки (электрон-позитронная конверсия, или εβ+-распад)
- захватываются два электрона (двойной электронный захват, 2ε-захват).
Предсказан, но ещё не открыт безнейтринный двойной бета-распад.
Общие свойства бета-распада
Все типы бета-распада сохраняют массовое число ядра, поскольку при любом бета-распаде общее количество нуклонов в ядре не изменяется, лишь один или два нейтрона превращаются в протоны (или наоборот).












Добавить комментарий